Solutions Rt-PCR Centre de connaissances
SARS-CoV-2
Antigen Test
Le LumiraDx SARS-CoV-2 Ag Test* est un test d’immunofluorescence microfluidique destiné à la détection qualitative directe de l’antigène de la protéine de la nucléocapside dans les échantillons sur écouvillon nasal et sur écouvillon nasopharyngé prélevés auprès de patients suspectés de COVID-19 ou de personnes asymptomatiques. Utilisé avec la LumiraDx Platform*, le test donne des résultats rapides sur le lieu des soins.
Bénéfices du test
L’utilisation du LumiraDx SARS-CoV-2 Ag Test sur les LumiraDx Instrument* permet au médecin de vérifier rapidement la présence d’une infection, d’instaurer le traitement approprié et de mettre en place des précautions d’isolement pour contribuer à prévenir la propagation de l’infection.
- Facile à mettre en œuvre sur le lieu de soins
- Performances cliniques
- Pourcentage de concordance positive de 97,6 %
- Pourcentage de concordance négative de 96,6 %
- Performance analytique avec une limite de détection de 32 DICT50/mL
- Résultats comparables à ceux de la RT-PCR dans les 12 jours suivant l’apparition des symptômes
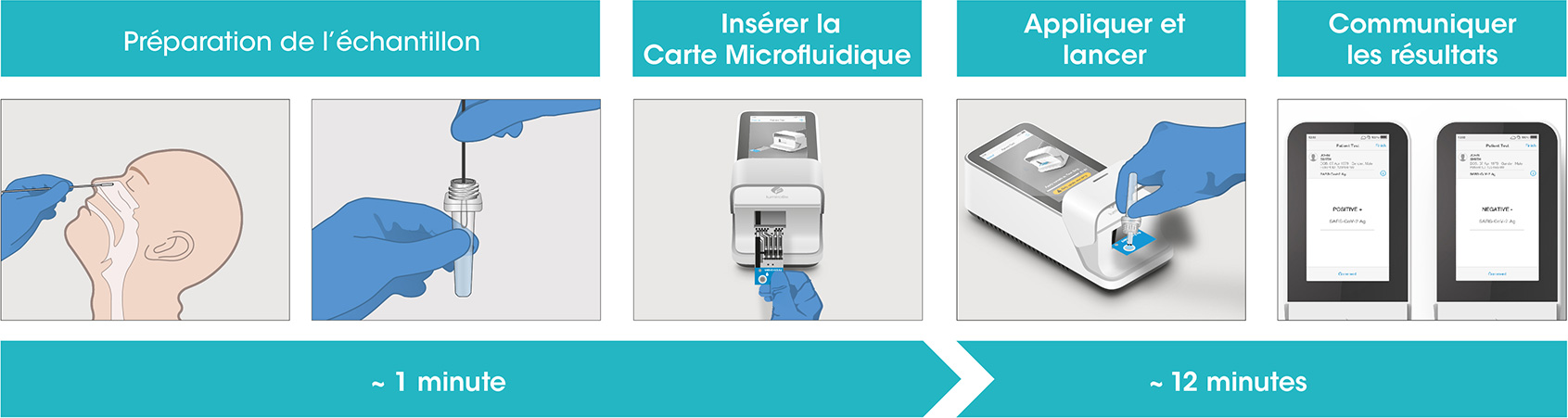
Procédure
L’Instrument et les Cartes microfluidiques sont contrôlés à chaque étape de la procédure pour garantir le bon fonctionnement de l'Instrument et du test lors de chaque exécution de test.
La procédure nécessite une préparation du prélèvement puis le suivi des étapes indiquées sur l’écran de l’automate, le résultat est disponible en 12 minutes après le dépôt de l’échantillon.
Performances du test
Dans les études cliniques, le LumiraDx SARS-CoV-2 Ag Test a démontré une concordance positive de 97,6 % par rapport à la PCR chez les patients testés dans les 12 jours suivant l’apparition des symptômes. Le médecin peut ainsi vérifier rapidement la présence d’une infection, instaurer le traitement approprié et mettre en place des mesures d’isolement pour contribuer à prévenir la propagation de l’infection.
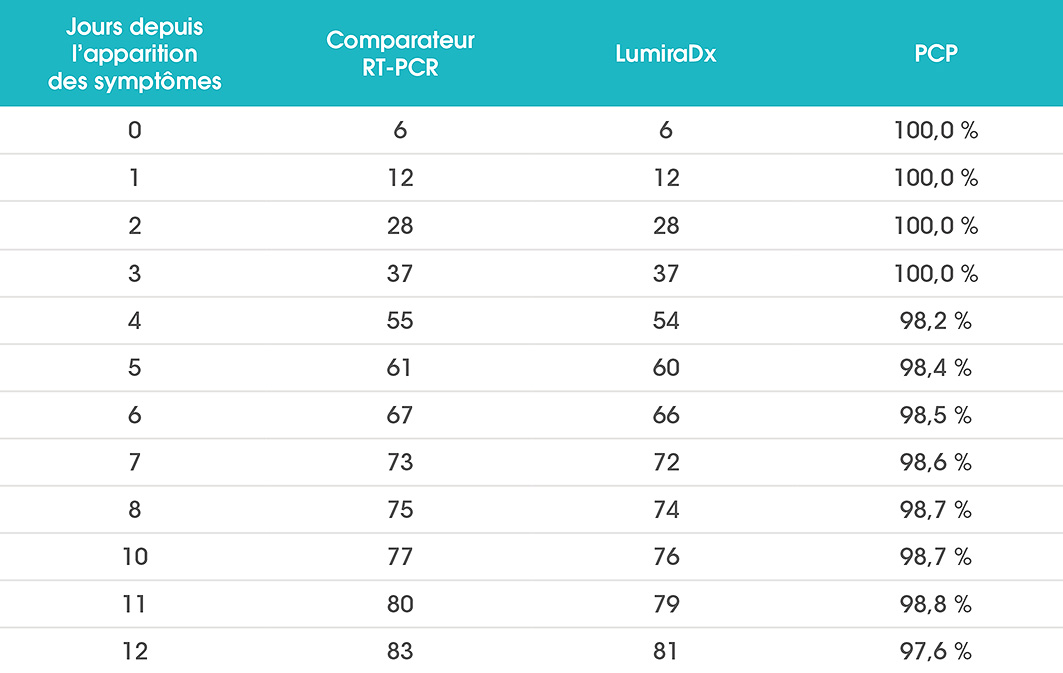
Une concordance positive de 100 % a été atteinte avec les échantillons à des valeurs seuils de cycle (Ct) < 33 (méthode de référence pour le SARS-CoV-2 sur Cobas 6800 de Roche)
Performances de la méthode d’écouvillonage 12 jours après le test RT-PCR
| PCP | PCN | Seuil de cycle PCR <33 | |
|---|---|---|---|
| Écouvillon nasal | 97,6 % | 96,6 % | 100 % |
| Écouvillon nasopharyngé | 97,5 % | 97,7 % | 100 % |
Pour de plus amples informations
sur le LumiraDx SARS-CoV-2 Ag Test:
Les produits ne sont pas tous disponibles dans tous les pays et régions. Vérifiez leur disponibilité sur les marchés concernés auprès de votre représentant commercial ou de votre distributeur local LumiraDx. Disponible aux États-Unis au titre de l’autorisation d’utilisation d’urgence accordée aux tests du SARSCoV-2.
*LumiraDx Platform - Plateforme LumiraDx; LumiraDx Instrument – Automate; LumiraDx SARS-CoV-2 Ag Test - Test COVID-19 Ag Antigénique; LumiraDx SARS-CoV-2 Ag Pool Test - COVID-19 Test groupé SARS-CoV-2 Ag; LumiraDx SARS-CoV-2 Ab Test - Test COVID-19 Ab Anticorps; LumiraDx INR Test - Test INR; Lumiradx D-Dimer Test - Test D-Dimère; RNA STAR Complete - PCR RNA STAR COMPLETE COVID-19; RNA STAR COVID-19 - PCR RNA STAR COVID-19; LumiraDx Barcode Scanner - Lecteur code barre; Lumiradx Printer – Imprimante; Small in one – Tout-en-un.
Une meilleure santéDe meilleures expériencesDe meilleurs résultats
Participer à l’amélioration de la prise en charge des patients, de la communauté et la société en général.
Faciliter les relations entre les patients et les équipes de soins.
Contrôler et réduire les coûts pour alléger la pression sur les budgets des soins de santé.
