Fast Lab Solutions Knowledge Center
SARS-CoV-2
Test de antígenos
LumiraDx SARS -CoV-2 Ag Test es un ensayo de inmunofluorescencia microfluídica para la detección directa y cualitativa de antígeno de proteína nucleocápside en muestras de hisopos nasales y nasofaríngeos de individuos sospechosos de COVID 19 o individuos asintomáticos. Usado con LumiraDx Platform el test obtiene resultados rápidos en el punto de atención.
Beneficios del test
El uso del LumiraDx SARS-CoV-2 Ag Test con LumiraDx Instruments permite al médico verificar rápidamente la infección, iniciar el tratamiento adecuado e instaurar medidas de aislamiento que ayuden a evitar que la infección se siga propagando.
- Fácil implementación en los entornos de los puntos de atención
- Rendimiento clínico
- Concordancia porcentual positiva del 97,6 %
- Concordancia porcentual negativa del 96,6 %
- Rendimiento analítico con un límite de detección de 32 TCID50/mL
- Resultados comparables de RT-PCR dentro de los 12 días posteriores al inicio de los síntomas
Flujo de trabajo del test
El Instrument y las Tiras Reactivas se integran con diversas comprobaciones de control de calidad para garantizar que el Instrument y el test funcionen correctamente en cada ejecución del test.
El proceso del flujo de trabajo consiste en una sencilla preparación de la muestra acompañada de una guía paso a paso del Instrument para presentar el resultado de un paciente en menos de 12 minutos desde la aplicación de la muestra.

Rendimiento del test
En los estudios clínicos, LumiraDx SARS-CoV-2 Ag Test ha demostrado una concordancia positiva del 97,6 % frente a la PCR en pacientes analizados en el plazo de 12 días desde la aparición de los síntomas, lo que permite al médico verificar rápidamente la infección, iniciar el tratamiento adecuado e instaurar medidas de aislamiento que ayuden a evitar que la infección se siga propagando.
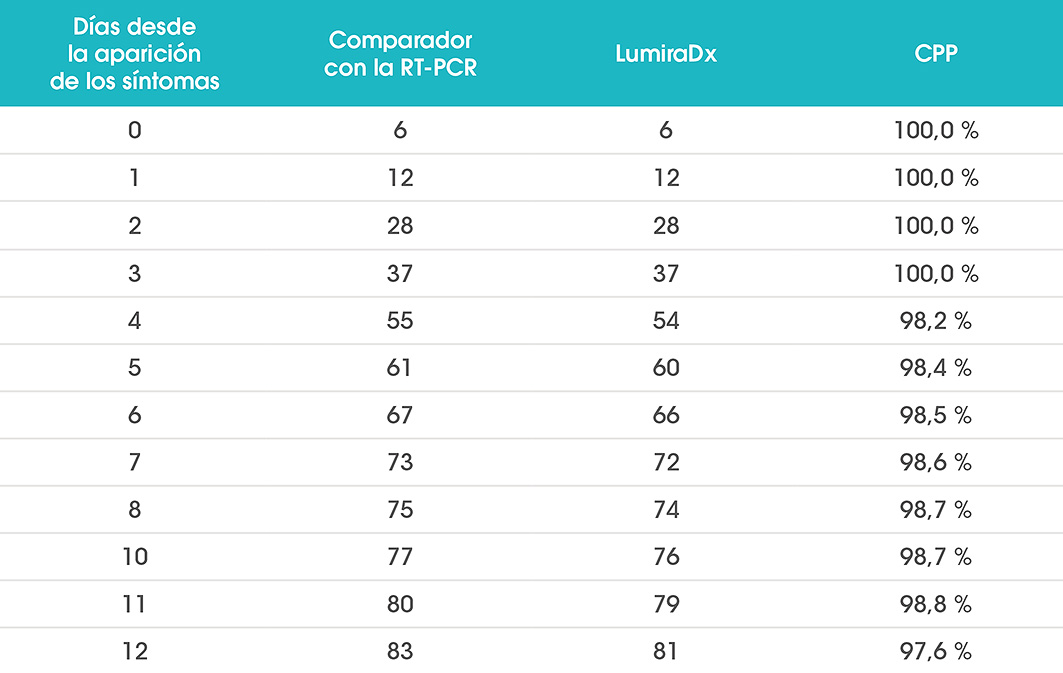
Se alcanzó una concordancia positiva del 100 % con muestras con valores de umbral del ciclo (Ct) < 33 (método de referencia Roche Cobas 6800 SARS-CoV-2)
Rendimiento del método de hisopo 12 días después del test RT-PCR
| CPP | CPN | Umbral del ciclo PCR <33 | |
|---|---|---|---|
| Hisopo nasal | 97,6 % | 96,6 % | 100 % |
| Hisopo nasofaríngeo | 97,5 % | 97,7 % | 100 % |
Para obtener más información
sobre el LumiraDx SARS-CoV-2 Ag Test
No todos los productos están disponibles en todos los países y regiones Compruebe la disponibilidad en cada mercado con su distribuidor o representante de ventas local de LumiraDx. Disponible en los EE. UU. en virtud de la Autorización de Uso de Emergencia (Emergency Use Authorization, EUA) para los ensayos de SARS-CoV-2.
Mejor saludMejores experienciasMejores resultados
Fomentando vidas más sanas entre las personas, las comunidades y la sociedad en general.
Permitiendo relaciones personales sensibles entre pacientes y equipos sanitarios.
Controlando y reduciendo los costes para ayudar a reducir la presión ejercida en los presupuestos sanitarios.